Bài 29. Quá trình đẳng nhiệt. Định luật Bôi-lơ- Ma-ri-ốt
Nội dung lý thuyết
Các phiên bản khácQUÁ TRÌNH ĐẲNG NHIỆT. ĐỊNH LUẬT BÔI-LƠ MA-RI-ỐT
1. Trạng thái và quá trình biến đổi trạng thái
- Trạng thái khí nhất định được xác định bằng 3 thông số: thể tích \(V\), nhiệt độ \(T\) và áp suất \(p\)
- Khi trạng thái của khí khí biến đổi thì các thông số thể tích (\(V\)), nhiệt độ (\(T\)), áp suất (\(p\)) của khối khí thay đổi
2. Quá trình dẳng nhiệt
Là quá trình biến đổi trạng thái của một khối khí xác định trong đó nhiệt độ được giữ không đổi gọi là quá trình đẳng nhiệt.
3. Định luật Bôi-Lơ Ma-Ri-ốt
Từ những quan sát hằng ngày và những thí nghiệm đơn giản, ta thấy rằng, khi nhiệt độ không đổi, nếu thể tích của một lượng khí giảm thì áp suất của nó tăng.
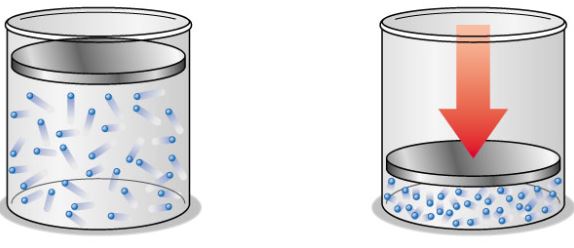
Định luật Bôi-lơ Ma-ri-ốt
Trong quá trình đẳng nhiệt của một lượng khí lí tưởng nhất định, áp suất tỉ lệ nghịch với thể tích
\(p\sim \dfrac{1}{V}\) hay \(pV=\text{ hằng số}\)
Trong đó: \(p\) là áp suất và \(V\) là thể tích của khối khí
Nếu \(p_1,V_1\) là áp suất và thể tích của một lượng khí ở trạng thái 1
\(p_2,V_2\) là áp suất và thể tích của một lượng khí ở trạng thái 2
Thì theo định luật Bôi-lơ Ma-ri-ốt ta có
\({{p}_{1}}.{{V}_{1}}={{p}_{2}}{{V}_{2}}\Leftrightarrow \frac{{{p}_{1}}}{{{p}_{2}}}=\frac{{{V}_{2}}}{{{V}_{1}}}\)
Lưu ý: 1atm = 1bar = 760mmHg = 105 Pa = 105 N/m2
1m3 = 103 dm3 = 103 lít = 106 cm3 = 109 mm3
4. Đường đẳng nhiệt

- Đường biểu diễn sự biến thiên của áp suất theo thể tích khi nhiệt độ không đổi gọi là đường đẳng nhiệt
- Trong giản đồ áp suất – thể tích (PV) đường nào nằm trên thì có nhiệt độ cao hơn
Danh sách các phiên bản khác của bài học này. Xem hướng dẫn