Bài 1. Sự chuyển thể của các chất
Nội dung lý thuyết
Các phiên bản khácI. SƠ LƯỢC CẤU TRÚC CỦA CHẤT RẮN, CHẤT LỎNG, CHẤT KHÍ
1. Mô hình động học phân tử
Để mô tả cấu trúc và giải thích một số tính chất của chất rắn, chất lỏng, chất khí người ta sử dụng một mô hình được gọi là mô hình động học phân tử. Mô hình này được xây dựng dựa trên các giả thuyết sau:
- Các chất được câu tạo từ các hạt (phân tử, nguyên tử, ion), sau đây gọi chung là các phân tử.
- Các phân từ chuyển động không ngừng. Chuyển động của các phân từ được gọi là chuyển động nhiệt.
- Các phân tử chuyển động càng nhanh thì nhiệt độ của vật do chúng tạo nên càng cao.
- Giữa các phân tử có lực tương tác, bao gồm lực hút và lực đấy. Độ lớn của những lực này phụ thuộc vào khoảng cách giữa các phân tử. Khi khoảng cách giữa các phân từ nhỏ đến một mức nào đấy thì lực đẩy mạnh hơn lực hút. Khi khoảng cách giữa các phân tử lớn thì lực hút mạnh hơn lực đẩy. Khi khoảng cách giữa các phân tử lớn hơn rất nhiều so với kích thước phân từ thị lực tương tác giữa chúng coi như không đáng kể.
Với mô hình động học phân tử, sự khác biệt về độ lớn của lực tương tác giữa các phân từ trong các thể dẫn đến sự khác biệt về cấu trúc của chất rắn, chất lỏng và chất khí.
2. Sơ lược cấu trúc của chất rắn
Trong chất rắn, các phân tử ở rất gần nhau (Hình 1.2a).
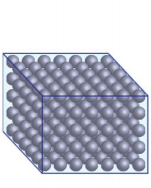
Lực tương tác giữa các phân tử chất rắn rất mạnh nên giữ được các phân tử ở các vị trí cân bằng và mỗi phân tử chỉ có thể dao động xung quanh vị trí cân bằng xác định này. Do đó, các chất ở thể rắn có thể tích và hình dạng xác định.
Chất rắn được phân thành hai loại : chất rắn kết tinh và chất rắn vô định hình.
- Chất rắn kết tinh (hay chất rắn tinh thể) có cấu trúc tinh thể. Đó là cấu trúc tạo bởi các hạt (nguyên tử, phân tử, ion) liên kết chặt với nhau và sắp xếp theo một trật tự hình học xác định, tuần hoàn trong không gian, gọi là mạng tinh thể. Muối ăn, kim cương, hầu hết kim loại,... là những chất rắn kết tinh.
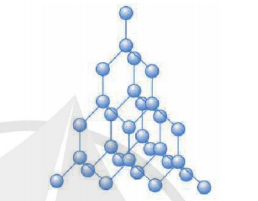
- Chất rắn vô định hình không có cấu trúc tỉnh thể. Thuỷ tỉnh, nhựa đường, cao su,... là những chất rắn vô định hình.
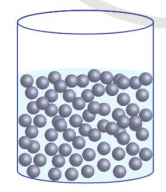
3. Sơ lược cấu trúc của chất lỏng
Trong chất lỏng (Hình 1.2b), các phân tử ở xa nhau hơn so với các phân tử trong chất rắn. Lực tương tác giữa các phân tử chất lỏng nhỏ hơn trong chất rắn nên không giữ được các phân tử ở các vị trí xác định nhưng vẫn đủ để giữ các phân tử không chuyển động phân tán ra xa nhau. Các phân từ chất lỏng linh động hơn các phân tử chất rắn do chúng dao động xung quanh các vị trí cân bằng và các vị trí cân bằng này lại có thể dịch chuyển. Vì thế, một lượng chất lông có thể tích xác định nhưng không có hình dạng riêng mà có hình dạng của phần bình chứa nó.
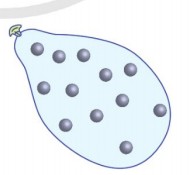
4. Sơ lược cấu trúc của chất khí
Trong chất khí (Hình 1.2c), các phân từ ở xa nhau hơn so với các phân từ trong chất lỏng. Khoảng cách giữa các phân từ rất lớn so với kích thước của chúng nên lực tương tác giữa các phân tử hầu như không đáng kể (trừ khi va chạm nhau).
Các phân tử chất khí chuyển động hỗn loạn, không ngừng về mọi phía, chiếm toàn bộ không gian của bình chứa. Vì vậy, một lượng khí không có thể tích và hình dạng riêng mà có thể tích và hình dạng của bình chứa.
II. SỰ CHUYỂN THỂ
1. Sự chuyển thể của chất
Khi các điều kiện như nhiệt độ và áp suất thay đổi, một chất có thể chuyển từ thể này sang thể khác.
Quá trình chuyển từ thể rắn sang thể lỏng của các chất được gọi là sự nóng chảy. Quá trình chuyển ngược lại, từ thể lỏng sang thể rắn được gọi là sự đông đặc.
Quá trình chuyển từ thể lỏng sang thể khí (hơi) của các chất được gọi là sự hóa hơi (bao gồm bay hơi và sôi). Quá trình chuyển ngược lại, từ thể khí (hơi) sang thể lỏng được gọi là sự ngưng tụ.
Mô hình động học phân tử giúp giải thích các hiện tượng quan sát được trong các quá trình chuyển thế này.
2. Giải thích sự nóng chảy
Khi nung nóng một vật rắn kết tinh, các phân tử của vật rắn nhận được nhiệt lượng, dao động của các phân tử mạnh lên, biên độ dao động tăng. Điều này dẫn đến khoảng cách trung bình giữa các phân từ tăng.
Nhiệt độ của vật rắn tăng đến một giá trị nào đó thì một số phân từ thắng được lực tương tác với các phân tử xung quanh và thoát khỏi liên kết với chúng, đó là sự khởi đầu của quá trình nóng chảy. Từ lúc này, vật rắn nhận nhiệt lượng để tiếp tục phá vỡ các liên kết tinh thể. Khi trật tự của tinh thể bị phá vỡ hoàn toàn thì quá trình nóng chảy kết thúc, vật rắn chuyển thành khối lỏng.
Nếu vẫn tiếp tục nung nóng thì các phân từ nhận nhiệt lượng để tăng năng lượng chuyển động của mình và nhiệt độ của khối chất lỏng tăng lên.
Phần năng lượng nhận thêm để phá vỡ liên kết giữa các phân từ mà không làm tăng nhiệt độ của chất trong quá trình chuyển thể thường được gọi là ẩn nhiệt. Từ "ẩn" thể hiện ý nghĩa năng lượng cung cấp cho chất có vẻ bị biến mất vì nhiệt độ của chất không tăng khi chuyển thể. Năng lượng này trong quá trình nóng chảy được gọi là ẩn nhiệt nóng chảy.
Ví dụ : Cho một ít nước đá có nhiệt độ dưới 0 °C vào trong một bình chứa. Đun nóng bình chứa thi nhiệt độ của nước đá tăng dần đến 0 °C. Khi đạt 0 °C, nước đá tan dần thành nước.
Tròn suốt thời gian nước đá chuyển thành nước, nhiệt độ của hệ (nước đá và nước) không đổi, luôn ở 0 °C. Ta lấy 0 °C là nhiệt độ nóng chảy của nước đá.
3. Giải thích sự hóa hơi
Khi các phân tử chất lỏng nhận được năng lượng, chúng sẽ chuyển động nhanh hơn làm nhiệt độ chất lỏng tăng dần. Một số phân tử chất lỏng ở gần bề mặt khối chất lỏng chuyển động hướng ra ngoài (Hình 1.6). Một số trong những phân tử này có động năng đủ lớn, thắng được lực tương tác giữa các phân tử thì có thể thoát ra ngoài khối chất lỏng. Ta nói chất lỏng bay hơi. Như vậy, có thể nói sự bay hơi là sự hoá hơi xảy ra ở mặt thoáng của khối chất lỏng.
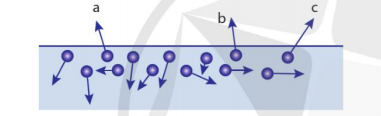
Đồng thời, ở gần bề mặt khối chất lỏng, một số phân tử hơi chuyển động hỗn loạn va chạm vào chất lỏng và bị các phân tử chất lỏng hút vào khối chất lỏng. Ta gọi đó là sự ngưng tụ.
Ở áp suất tiêu chuẩn (1 atm), mỗi chất lỏng sôi ở một nhiệt độ xác định, nhiệt độ đó được gọi là nhiệt độ sôi của chất. Khi chất lỏng sôi, sự hóa hơi của chất lỏng xảy ra ở cả trong lòng và bề mặt chất lỏng.
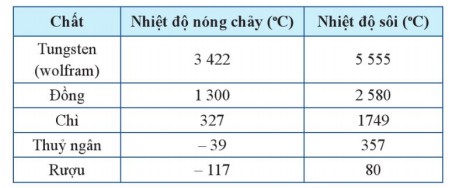
Nhiệt độ nóng chảy và nhiệt độ sôi của một số chất được cho ở Bảng 1.2.
Trong quá trình hóa hơi, dù được cung cấp năng lượng liên tục nhưng khi đạt đến nhiệt độ sôi thì chất lông không tăng nhiệt độ suốt thời gian chuyển hoàn toàn thành chất khí. Lúc này, các phân từ nhận thêm năng lượng dùng để phá vỡ liên kết với các phân tử xung quanh, khiến phân từ chuyển động tự do. Chất lòng chuyển thành chất khí.
Phần năng lương nhận thêm để phá vỡ liên kết giữa các phân tử mà không làm tăng nhiệt độ của chất trong quá trình hoa bấ được gọi là ẩn nhiệt hóa hơi.
Ví dụ: Đun nóng bình chứa nước thì nhiệt độ của nước tăng dần đến 100 °C. Khi đạt 100 °C, nước sôi và chuyến dần thành hơi nước. Trong suốt thời gian chuyến thành hơi nước, nhiệt độ của nước không đôi, luôn ở 100 °C. Ta lấy 100 °C là nhiệt độ sôi của nước.