Phân tử có 2 liên kết đơn: H-O
2 liên kết đơn: S-O
2 liên kết đôi S=O
Phân tử có 2 liên kết đơn: H-O
2 liên kết đơn: S-O
2 liên kết đôi S=O
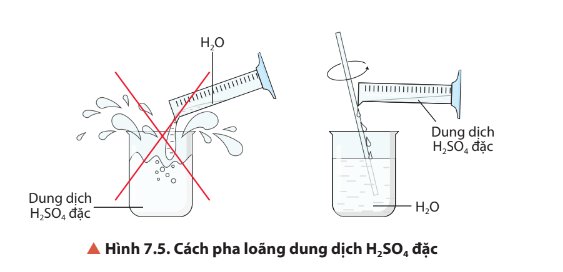
Quan sát Hình 7.5, mô tả cách pha loãng sulfuric acid. Giải thích.
Thí nghiệm 2. Phản ứng của dung dịch H2SO4 đặc với đường
Dụng cụ: cốc thuỷ tinh.
Hoá chất: dung dịch H2SO4đặc, đường tinh luyện.
Tiến hành: Cho một thìa nhỏ đường vào cốc thuỷ tinh. Nhỏ vài giọt dung dịch H2SO4 đặc vào cốc.
Quan sát và mô tả hiện tượng xảy ra.
Thí nghiệm 1. Phản ứng của dung dịch H2SO4 đặc, nóng với Cu
Dụng cụ: ống nghiệm, kẹp ống nghiệm, đèn cồn.
Hoá chất: dung dịch H2SO4 đặc, dung dịch NaOH, mảnh đồng, bông.
Tiến hành: Cho khoảng 2 mL dung dịch H2SO4 đặc vào ống nghiệm. Cho một mảnh đồng vào ống nghiệm, đun nóng nhẹ trên ngọn lửa đèn cồn. Dùng bông tẩm dung dịch NaOH đậy trên miệng ống nghiệm.
Quan sát và mô tả hiện tượng xảy ra.
Viết phương trình hoá học khi cho dung dịch H2SO4 đặc tác dụng với KBr, C. Cho biết sản phẩm khử duy nhất là SO2.
Trong phân tử của H2SO4, các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị. 2 liên kết đơn O – H, 2 liên kết đơn O – S và 2 liên kết đôi S = O.
Quan sát Hình 7.1 nhận xét màu, trạng thái của sulfuric acid ở điều kiện thường và cho biết tại sao sulfuric acid lại không bay hơi.

Quan sát Hình 7.6, trình bày cách nhận biết ion . Nêu hiện tượng xảy ra, viết phương trình hoá học.’

Hãy giải thích vì sao ở giai đoạn tạo ra SO3 người ta chọn điều kiện phản ứng ở nhiệt độ cao (450 °C - 500 °C).
Sulfuric acid là hoá chất hàng đầu trong nhiều ngành sản xuất, được mệnh danh là “máu” của các ngành công nghiệp. Sản lượng sulfuric acid của một quốc gia là một trong những chỉ số đánh giá sức mạnh công nghiệp hoá chất của quốc gia đó. Sulfuric acid có tính chất và ứng dụng gì trong đời sống?