Quan sát Hình 2.1, em hãy nêu những sự khác nhau giữa chất điện li và chất không điện li.
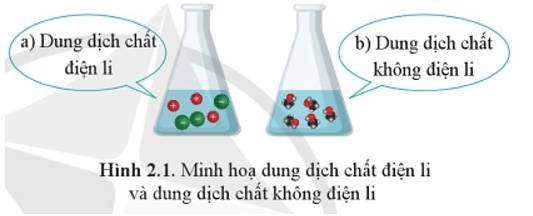
Quan sát Hình 2.1, em hãy nêu những sự khác nhau giữa chất điện li và chất không điện li.

Trong thí nghiệm trên, đèn sáng hay không sáng chứng tỏ tính chất vật lí nào của dung dịch chất tan?
Trong thí nghiệm, đèn sáng hay không sáng chứng tỏ tính dẫn điện của dung dịch chất tan.
+ Đèn sáng chứng tỏ dung dịch chất tan dẫn điện.
+ Đèn không sáng chứng tỏ dung dịch chất tan không dẫn điện.
Trả lời bởi HT.Phong (9A5)Dự đoán trong thí nghiệm trên, cốc thuỷ tinh chứa nước nguyên chất thì đèn sáng hay không.
Cốc thuỷ tinh chứa nước nguyên chất thì đèn không sáng vì nước nguyên chất là chất điện li rất yếu.
Trả lời bởi Phước LộcTìm hiểu và cho biết những chất nào sau đây thuộc loại chất điện li: HCl, Fe, BaCl2, Ca(OH)2, CH3COOH, O2.
Ở quá trình (3b), nước đóng vai trò là acid hay base? Vì sao?
Ta có:
\(HCl+H_2O\rightarrow H_3O^++Cl^-\)
Nước đóng vai trò là base. Vì nước nhận H+ để tạo ion H3O+.
Trả lời bởi HT.Phong (9A5)Trong cân bằng (4), hãy chỉ ra hai acid và hai base. Giải thích.
Dựa vào cân bằng (4) và (5), hãy giải thích vì sao H2O được cho là chất có tính lưỡng tính (là chất vừa có tính acid, vừa có tính base).
Cho các phân tử sau: HBr, HI, H2S, KOH. Hãy phân loại chúng thành acid mạnh, base mạnh, acid yếu và base yếu.
\(\begin{array}{l}HBr \to {H^ + } + B{r^ - }\\HI \to {H^ + } + {I^ - }\\{H_2}S \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + H{S^ - }\\HS - \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + {S^{2 - }}\\KOH \to {K^ + } + O{H^ - }\\N{H_3} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_4}^ + + O{H^ - }\end{array}\)
Acid mạnh: HBr, HI
Acid yếu: H2S
Base mạnh: KOH
Base yếu: NH3
Trả lời bởi Quoc Tran Anh LeTrong các cân bằng (7), (8a) và (8b), xác định các acid và các base.
Tương tự Ví dụ 5, hãy cho biết dung dịch phèn sắt (NH4Fe(SO4)2.12H2O) có môi trường acid hay base. Giải thích. Vì sao người ta có thể dùng phèn sắt để loại bỏ các chất lơ lửng trong nước?
Sự khác nhau giữa chất điện li và chất không điện li:
+ Chất điện li là chất khi tan trong nước phân li thành ion.
+ Chất không điện li là chất khi tan trong nước không phân li thành ion.
Trả lời bởi HT.Phong (9A5)