Cho đinh sắt đã được đánh sạch bề mặt vào dung dịch của một trong các muối sau (có nồng độ 1M): aluminium chloride, zinc nitrate, copper(II) sulfate, lead(II) nitrate.
a) Trường hợp nào có phản ứng tạo thành kim loại? Nêu vai trò của mỗi chất tham gia phản ứng.
b) Viết các phương trình hóa học của phản ứng ở dạng ion thu gọn.
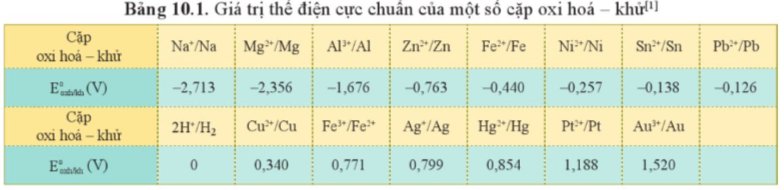
a) Ta có:
\(E^o_{Fe^{2+}\text{/}Fe}=-0,44V;E^o_{Al^{3+}\text{/}Al}=-1,676V;E^o_{Zn^{2+}\text{/}Zn}=-0,763V;E^o_{Cu^{2+}\text{/}Cu}=0,34V;E^o_{Pb^{2+}\text{/}Pb}=-0,126V\).Như vậy sắt có thế điện cực chuẩn nhỏ hơn của đồng và chì.
Trường hợp có phản ứng tạo thành kim loại là:
+ Cho đinh sắt vào dung dịch copper(II) sulfate. Khi đó sắt (Fe) đóng vai trò là chất khử, copper(II) sulfate (CuSO4) đóng vai trò là chất oxi hóa.
+ Cho đinh sắt vào dung dịch lead(II) nitrate. Khi đó sắt (Fe) đóng vai trò là chất khử, lead(II) nitrate (Pb(NO3)2) đóng vai trò là chất oxi hóa.
b) Phương trình hoá học ở dạng ion thu gọn.
Fe(s) + Cu2+(aq) ⟶ Fe2+(aq) + Cu(s)
Fe(s) + Pb2+(aq) ⟶ Fe2+(aq) + Pb(s)
Trả lời bởi Nguyễn Quốc Đạt